Для улучшения работы сайта мы используем файлы cookie. Продолжая просматривать сайт, вы соглашаетесь с этим.
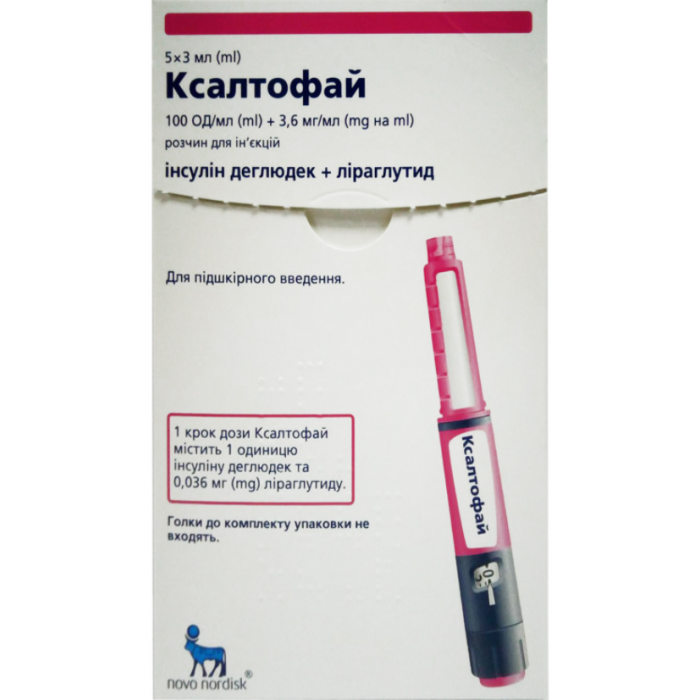
Ксалтофай 100 ЕД/мл + 3,6 мг/мл раствор для инъекций шприц-ручка 3 мл №5
8 731,35 ₴
Novo Nordisk (Дания)

Арт.
748152

В список
Ксалтофай 100 ЕД/мл + 3,6 мг/мл раствор для инъекций шприц-ручка 3 мл №5 Novo Nordisk (Дания)
Novo Nordisk (Дания)
Внимание! Цены действительны только при покупке онлайн
Ваш город - Киев?
Ваш город
Выбрать
Товар отсутствует в аптеках выбранного города

Самовывоз
Бесплатно

Курьером
Доставка до 48 часов
От 2000 грн бесплатно
Рецептурный препарат. Возможен только самовывоз с аптеки

Новая Почта отделение
Доставка от 1 дня
От 80 грн

Новая Почта почтомат
Доставка от 1 дня
От 80 грн

Новая Почта курьер
Доставка от 1 дня
От 150 грн

Укрпочта отделение
Доставка от 2 дней
от 50 грн
На сайте
При получении
Остались вопросы?
Мы рады помочь
Характеристики товара
| Производитель | Novo Nordisk (Дания) |
|---|---|
| Главный медикамент | Инсулин градус, лираглутид |
| Форма товара | Шприц-ручка |
| Способ применения | Подкожный |
| Взаемодействие с алкоголем | Критическая |
| Признак | Импортный |
| Штрих-код | 5712249115173 |
| Взаимодействие с едой | До еды |
| Бренд | Ксалтофай |
| Объём | 3 мл |
| Условия отпуска | по рецепту |
| Назначение | Для диабетиков |
| Температура хранения | от 2°C до 8°C |
Инструкция предоставлена Гос. реестром мед. препаратов Украины

Проверено: Громадская Яна

Проверено: Кортунова Юлия
Обновлено 13.11.2024
Проверено
Инструкция
Ксалтофай (Xultophy) инструкция по применению
Состав
действующие вещества: инсулин деглюдек, лираглутид;
1 мл раствора содержит:
-
100 ЕД инсулина деглюдек* и 3,6 мг лираглутида*.
1 предварительно заполненная шприц-ручка содержит:
-
3 мл, что эквивалентно 300 ЕД инсулина деглюдек и 10,8 мг лираглутида;
другие составляющие: глицерин, фенол, цинка ацетат, кислота хлористоводородная (для коррекции pH), натрия гидроксид (для коррекции pH), вода для инъекций.
*Произведены по технологии рекомбинантной ДНК в Saccharomyces cerevisiae.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: прозрачный, бесцветный, изотонический раствор.
Фармакотерапевтическая группа
Лекарственные средства, применяемые при сахарном диабете. Инсулины и аналоги продолжительного действия для инъекций.
Код ATX A10A E56.
Фармакологические свойства
Фармакодинамика.
Механизм деяния.
Ксалтофай представляет собой комбинированное лекарственное средство, состоящее из инсулина деглюдек и лираглутида, механизмы действия которых дополняют друг друга, улучшая гликемический контроль.
Инсулин деглюдек – базальный инсулин, который после подкожной инъекции образует растворимый мультигексамер. В результате формируется депо, из которого инсулин деглюдек непрерывно и медленно всасывается в кровоток, что влечет за собой ровный и устойчивый эффект снижения уровня глюкозы в крови с низкой ежедневной вариабельностью действия инсулина.
Инсулин деглюдек специфически связывается с рецептором инсулина человека, обеспечивая такой же фармакологический эффект, что и инсулин человека.
Сахароснижающий эффект инсулина деглюдек заключается в содействии поглощению глюкозы после связывания инсулина с рецепторами мышечных и жировых клеток, а также в одновременном угнетении выделения глюкозы из печени.
Лираглутид является аналогом глюкагонообразного пептида-1 (ГПП-1) с последовательностью аминокислот, что на 97% гомологическая ГПП-1 человека, он связывается с рецептором ГПП-1 (ГПП-1Р) и активирует его. Пролонгированное действие введенного подкожно лираглутида обусловлено тремя механизмами: самоассоциацией, замедляющей всасывание, связыванием с альбумином крови и повышенной устойчивостью к действию ферментов дипептидилпептидазы 4 (ДПП-4) и нейтральной эндопептиды. .
Действие лираглутида происходит за счет специфического взаимодействия с рецепторами ГПП-1 и способствует улучшению гликемического контроля путем снижения уровней глюкозы в крови натощак и после еды. Лираглутид стимулирует секрецию инсулина и уменьшает чрезмерно высокую секрецию глюкагона глюкозозависимым путем. Таким образом, когда уровень глюкозы в крови высок, происходит стимулирование секреции инсулина и угнетение секреции глюкагона. И наоборот, при гипогликемии лираглутид ослабляет секрецию инсулина и не препятствует секреции глюкагона. Кроме того, механизм снижения уровня глюкозы в крови также обусловлен незначительной задержкой опорожнения желудка. Лираглутид снижает массу тела и уменьшает массу жировой ткани благодаря механизмам, включающим уменьшение ощущения голода и снижение потребления энергии.
ГПП-1 является физраствором аппетита и потребления пищи, однако точный механизм его действия пока не выяснен полностью. В ходе исследований на животных периферийное введение лираглутида приводило к поглощению препарата специфическими участками головного мозга, задействованными в процессах регуляции аппетита, в которых лираглутид из-за специфической активации ГПП-1Р усиливал сигналы насыщения и ослаблял сигналы голода, тем самым вызывая уменьшение.
Рецепторы ГПП-1 представлены также в специфических участках сердца, сосудов, иммунной системы и почек. В экспериментальных моделях атеросклероза на мышах лираглутид предотвращал дальнейшее развитие аортальной бляшки и снижал степень воспаления в бляшке. Кроме того, лираглутид благоприятно влиял на липиды плазмы крови. Лираглутид не уменьшал размер уже имеющихся бляшек.
Фармакодинамические эффекты.
Ксалтофай имеет стабильный фармакодинамический профиль с длительностью действия, что является результатом комбинированного действия инсулина деглюдек и лираглутида, что позволяет Ксалтофай применять один раз в сутки в любое время независимо от приема пищи. Ксалтофай улучшает гликемический контроль путем устойчивого снижения уровней глюкозы в крови натощак и после приема пищи.
Снижение уровня глюкозы после приема пищи было подтверждено в ходе вспомогательного исследования продолжительностью 4 ч после стандартизированного приема пищи у пациентов с неудовлетворительным контролем при применении монотерапии метформином или его комбинации с пиоглитазоном. Ксалтофай приводил к более значительному снижению уровня глюкозы в плазме крови после приема пищи (средний уровень за 4 часа), чем инсулин деглюдек. Результаты применения лекарственного средства Ксалтофай и лираглутида были одинаковыми.
Клиническая эффективность и сохранность.
Безопасность и эффективность лекарственного средства Ксалтофай оценивались в ходе рандомизированных 6 контролируемых исследований фазы 3 в параллельных группах с участием различных популяций пациентов с диабетом 2-го типа в зависимости от предыдущей противодиабетической терапии. Терапия препаратами сравнения включала применение базального инсулина, агонистов рецепторов ГПП-1, плацебо и базально-болюсного режима. Испытание длилось 26 недель с рандомизацией от 199 до 833 пациентов для приема лекарственного средства Ксалтофай. Одно исследование было дальше продлено до 52 недель. Во всех исследованиях начальная доза лекарственного средства определялась согласно инструкции по медицинскому применению; и дважды в неделю производилось титрование дозы лекарственного средства Ксалтофай (см. таблицу 1). Такой же алгоритм титрования дозы использовался и при применении препаратов сравнения базальных инсулинов. В ходе 5 исследований Ксалтофай продемонстрировал клинически и статистически значимое улучшение гликемического контроля против препаратов сравнения по уровню гликозилированного гемоглобина A1c (HbA 1c ), тогда как в одном исследовании было продемонстрировано одинаковое снижение HbA 1c в обеих группах лечения.
Таблица 1. Титрование дозы лечебного средства Ксалтофай.
|
Уровень глюкозы в плазме крови перед завтраком*, |
Коррекция дозы (два раза в неделю) |
|
|
ммоль/л |
мг/дл |
Ксалтофай (шаги дозы) |
|
<4,0 |
<72 |
˗2 |
|
4,0˗5,0 |
72˗90 |
0 |
|
> 5,0 |
> 90 |
+2 |
* Уровни глюкозы, измеренные пациентом самостоятельно. В ходе исследования применения лекарственного средства Ксалтофай, которое добавлялось к препаратам сульфонилмочевины, целевой уровень составлял 4,0-6,0 ммоль/л.
Гликемический контроль.
Добавление к пероральным сахароснижающим лекарственным средствам.
Добавление лекарственного средства Ксалтофай к метформину или к комбинации метформина и пиоглитазоном в ходе рандомизированного контролируемого исследования открытого типа длительностью 26 недель позволило 60,4% пациентов, применявших Ксалтофай, достичь целевого уровня HbA 1c < 7% без тверд . Эта доля пациентов была существенно больше, чем при применении инсулина деглюдек (40,9%; отношение шансов (ВШ): 2,28; p<0,0001), и схожей с долей пациентов при применении лираглутида (57,7%; ВШ). : 1,13;p = 0,3184).
Частота случаев подтвержденной гипогликемии была ниже при применении лекарственного средства Ксалтофай, чем при применении инсулина деглюдек независимо от степени гликемического контроля.
Частота случаев тяжелой гипогликемии (определявшейся как эпизод, при котором существует потребность в помощи со стороны другого человека) на один пациенто-год экспозиции (доля пациентов в процентах) составляла 0,01 (2 из 825 пациентов) при применении лекарственного средства Ксалтофай, 0 ,01 (2 из 412 пациентов) при применении инсулина деглюдек и 0,00 (ни один из 412 пациентов) при применении лираглутида. Частота случаев ночной гипогликемии была схожа при применении лекарственного средства Ксалтофай и инсулина деглюдек.
Вообще пациенты, принимавшие Ксалтофай, имели меньше побочных эффектов со стороны желудочно-кишечного тракта, чем получавшие лираглутид. Это может являться следствием более медленного (по сравнению с монотерапией лираглутидом) увеличения дозы лираглутида как компонента лекарственного средства Ксалтофай в период начала лечения.
Уровень эффективности и безопасности лекарственного средства Ксалтофай оставался стабильным в течение периода до 52 недель лечения. Снижение показателя HbA 1cот начального уровня до 52 недели лечения составляло 1,84% при применении лекарственного средства Ксалтофай при рассчитанной разнице между группами лечения – 0,65% по сравнению с результатами применения лираглутида (p < 0,0001) и – 0,46% в сравнимы с результатами применения инсулина деглюдек (p<0,0001). Масса тела уменьшилась на 0,4 кг с рассчитанной разницей между результатами лечения лекарственным средством Ксалтофай и инсулином деглюдек – 2,80 кг (p < 0,0001), а частота подтвержденных случаев гипогликемии оставалась на уровне 1,8 явления на один пациент-год. экспозиции, что свидетельствует о значительном снижении общего риска подтвержденной гипогликемии по сравнению с применением инсулина деглюдек.
Применение лекарственного средства Ксалтофай совместно с сульфонилмочевиной или комбинацией сульфонилмочевины с метформином изучалось в ходе рандомизированного плацебо контролируемого двойно слепого исследования продолжительностью 26 недель.
Частота случаев тяжелой гипогликемии на один пациенто-год экспозиции (доля пациентов в процентах) составляла 0,02 (2 из 288 пациентов) при применении лекарственного средства Ксалтофай и 0,00 (ни один из 146 пациентов) при применении плацебо.
Таблица 2. Результаты спустя 26 недель. Добавление к пероральным сахароснижающим лекарственным средствам.
|
|
Добавление к метформину ± пиоглитазон |
Добавление к сульфонилмочевине ± метформин |
|||
|
|
Халтофай |
Инсулин деглюдек |
Лираглутид |
Халтофай |
Платебо |
|
Н |
833 |
413 |
414 |
289 |
146 |
|
HbA 1c ,% Начало → конец исследования |
8,3→6,4 |
8,3→6,9 |
8,3→7,0 |
7,9→6,4 |
7,9→7,4 |
|
Средняя смена |
˗ 1,91 |
˗ 1,44 |
˗ 1,28 |
˗ 1,45 |
˗ 0,46 |
|
Рассчитана разница |
|
˗ 0,47 АВ [˗ 0,58; ˗ 0,36] |
˗ 0,64 АВ [˗ 0,75; ˗ 0,53] |
|
˗ 1,02 АБ [˗ 1,18; ˗ 0,87] |
|
Пациенты (%), достигшие HbA 1c < 7 % |
|
|
|
|
|
|
Все пациенты |
80,6 |
65,1 |
60,4 |
79,2 |
28,8 |
|
Рассчитанный показатель отношения шансов |
|
2,38 Б [1,78; 3,18] |
3,26 Б [2,45; 4,33] |
|
11,95 Б [7,22; 19,77] |
|
Пациенты (%), достигшие HbA 1c £ 6,5 % |
|
|
|
|
|
|
Все пациенты |
69,7 |
47,5 |
41,1 |
64,0 |
12,3 |
|
Рассчитанный показатель отношения шансов |
|
2,82 Б [2,17; 3,67] |
3,98 Б [3,05; 5,18] |
|
16,36 Б [9,05; 29,56] |
|
Частота случаев подтвержденной гипогликемии* на один пациенто-год экспозиции (доля пациентов в %) |
1,80 (31,9%) |
2,57 (38,6 %) |
0,22 (6,8 %) |
3,52 (41,7 %) |
1,35 (17,1 %) |
|
Рассчитанное соотношение |
|
0,68 переменного тока [0,53; 0,87] |
7,61 Б [5,17; 11,21] |
|
3,74 Б [2,28; 6,13] |
|
Масса тела, кг Начало → конец исследования |
87,2→86,7 |
87,4→89,0 |
87,4→84,4 |
87,2→87,7 |
89,3→88,3 |
|
Средняя смена |
˗ 0,5 |
1,6 |
˗ 3,0 |
0,5 |
˗ 1,0 |
|
Рассчитана разница |
|
˗ 2,22 АБ [˗ 2,64; ˗ 1,80] |
2,44 Б [2,02; 2,86] |
|
1,48 Б [0,90; 2,06] |
|
ГПН, ммоль/л Начало → конец исследования |
9,2→5,6 |
9,4→5,8 |
9,0→7,3 |
9,1→6,5 |
9,1→8,8 |
|
Средняя смена |
˗ 3,62 |
˗ 3,61 |
˗ 1,75 |
˗ 2,60 |
˗ 0,31 |
|
Рассчитана разница |
|
˗ 0,17 [˗ 0,41; 0,07] |
1,76 ˗ Б [˗ 2,0; ˗ 1,53] |
|
˗ 2,30 Б [˗ 2,72; ˗ 1,89] |
|
Доза в конце исследования Инсулин деглюдек, единиц |
38 |
53 |
- |
28 |
- |
|
Лираглутид, мг |
1,4 |
- |
1,8 |
1,0 |
- |
|
Рассчитана разница, доза инсулина деглюдек |
|
˗ 14,90 АБ [˗ 17,14; |
|
|
- |
Зарегистрированы показатели перед началом, в конце лечения и их изменение. Последние зарегистрированные показатели переданы. 95% доверительный интервал указан в квадратных скобках ([ ]).
* Подтвержденная гипогликемия определяется как тяжелая форма гипогликемии (эпизод, при котором требуется помощь со стороны другого человека) и/или легкая гипогликемия (уровень глюкозы в плазме крови < 3,1 ммоль/л, независимо от симптомов).
A Конечные точки с подтвержденным преимуществом лекарственного средства Ксалтофай по сравнению с препаратом сравнения;
В р < 0,0001;
С р < 0,05.
ГПН – уровень глюкозы в плазме крови натощак.
Переход от терапии агонистами рецепторов ГПП-1.
В ходе рандомизированного исследования открытого типа продолжительностью 26 недель изучался переход с терапии агонистами рецепторов ГПП-1 на лечение лекарственным средством Ксалтофай по сравнению с применением неизменной терапии агонистами рецепторов ГПП-1 (дозировка по инструкции для медицинского применения) с участием пациентов с сахаром го типа с неудовлетворительным контролем при применении агониста рецепторов ГПП-1 и метформина (74,2%) или его комбинации с пиоглитазоном (2,5%), с сульфонилмочевиной (21,2%) или с обоими препаратами (2,1%) .
Частота случаев тяжелой формы гипогликемии на один пациенто-год экспозиции (доля пациентов в процентах) составляла 0,01 (1 из 291 пациента) при применении лекарственного средства Ксалтофай и 0,00 (ни один из 199 пациентов) при применении агонистов рецепторов ГПП-1.
Таблица 3. Результаты спустя 26 недель. Переход из терапии агонистами рецепторов ГПП-1.
|
|
Переход с терапии агонистом рецепторов ГПП-1 |
|
|
|
Халтофай |
Агонист рецепторов ГПП-1 |
|
Н |
292 |
146 |
|
HbA 1c ,% |
|
|
|
Начало → конец исследования |
7,8→6,4 |
7,7→7,4 |
|
Средняя смена |
˗1,3 |
˗0,3 |
|
Рассчитана разница |
|
˗0,94 АВ [˗1,11; ˗0,78] |
|
Пациенты (%), достигшие HbA 1c < 7 % |
|
|
|
Все пациенты |
75,3 |
35,6 |
|
Рассчитанный показатель отношения шансов |
|
6,84 Б [4,28; 10,94] |
|
Пациенты (%), достигшие HbA 1c £ 6,5 % |
|
|
|
Все пациенты |
63,0 |
22,6 |
|
Рассчитанный показатель отношения шансов |
|
7,53 Б [4,58; 12,38] |
|
Частота случаев подтвержденной гипогликемии* на один пациенто-год экспозиции (доля пациентов в %) |
2,82 (32,0 %) |
0,12 (2,8 %) |
|
Рассчитанное соотношение |
|
25,36 Б [10,63; 60,51] |
|
Масса тела, кг |
|
|
|
Начало → конец исследования |
95,6→97,5 |
95,5→94,7 |
|
Средняя смена |
2,0 |
˗0,8 |
|
Рассчитана разница |
|
2,89 Б [2,17; 3,62] |
|
ГПН, ммоль/л |
|
|
|
Начало → конец исследования |
9,0→6,0 |
9,4→8,8 |
|
Средняя смена |
˗2,98 |
˗0,60 |
|
Рассчитана разница |
|
˗2,64 Б [˗3,03; ˗2,25] |
|
Доза в конце исследования |
|
Доза агониста рецепторов ГПП-1 должна оставаться неизменной с начала исследования. |
|
Инсулин деглюдек, единиц |
43 |
|
|
Лираглутид, мг |
1,6 |
|
|
Рассчитана разница, доза инсулина деглюдек |
|
|
Зарегистрированы показатели перед началом, в конце лечения и их изменение. Последние зарегистрированные показатели переданы. 95% доверительный интервал указан в квадратных скобках ([ ]).
* Подтвержденная гипогликемия определяется как тяжелая форма гипогликемии (эпизод, при котором требуется помощь со стороны другого человека) и/или легкая гипогликемия (уровень глюкозы в плазме крови < 3,1 ммоль/л, независимо от симптомов).
A Конечные точки с подтвержденным преимуществом лекарственного средства Ксалтофай по сравнению с препаратом сравнения; В р <0,001.
Переход из терапии базальным инсулином.
В ходе исследования продолжительностью 26 недель изучался переход из терапии инсулином гларгин (100 ЕД/мл) для лечения лекарственным средством Ксалтофай по сравнению с интенсификацией применения инсулина гларгин пациентам с неудовлетворительным контролем при применении инсулина гларгин (20-50 единиц) и. Применяемая в ходе этого исследования максимально допустимая доза лекарственного средства Ксалтофай составляла 50 шагов дозы, тогда максимальная доза инсулина гларгин не устанавливалась. У 54,3% пациентов, принимавших Ксалтофай, был достигнут целевой уровень HbA 1c < 7% без подтвержденных эпизодов гипогликемии по сравнению с 29,4% пациентов, принимавших инсулин гларгин (отношение шансов: 3,24; p < 0,001) .
Частота случаев тяжелой гипогликемии на один пациенто-год экспозиции (доля пациентов в процентах) составляла 0,00 (ни один из 278 пациентов) при применении лекарственного средства Ксалтофай и 0,01 (1 из 279 пациентов) при применении инсулина гларгин. Частота случаев ночной гипогликемии была значительно ниже при применении лекарственного средства Ксалтофай по сравнению с применением инсулина гларгин (рассчитанное отношение в зависимости от лечения: 0,17; p<0,001).
В ходе второго исследования, которое было рандомизированным двойно слепым исследованием длительностью 26 недель с участием пациентов с неудовлетворительным контролем при применении базального инсулина (20–40 единиц) и монотерапии метформином или его комбинации с сульфонилмочевиной/глинидами. или инсулин деглюдек. Применение базального инсулина и сульфонилмочевины/глинидов было прекращено при рандомизации. Максимально допустимая дозировка составляла 50 шагов дозы лекарственного средства Ксалтофайта 50 единиц для инсулина деглюдек. У 48,7% пациентов, получавших Ксалтофай, был достигнут целевой уровень HbA 1c< 7% без подтвержденных эпизодов гипогликемии. Эта доля была значительно больше, чем при применении инсулина деглюдек (15,6%; отношение шансов: 5,57; p<0,0001).
Частота случаев тяжелой гипогликемии на один пациенто-год экспозиции (доля пациентов в процентах) составляла 0,01 (1 из 199 пациентов) при применении лекарственного средства Ксалтофай и 0,00 (ни один из 199 пациентов) при применении инсулина деглюдек. Частота случаев ночной гипогликемии походила при лечении лекарственным средством Ксалтофай и инсулином деглюдек.
Таблица 4. Результаты спустя 26 недель. Переход из терапии базальным инсулином.
|
|
Переход из терапии инсулином гларгин (100 ЕД/мл) |
Переход из терапии базальным инсулином [НПХ-инсулин (нейтральный протамин Хагедорна), инсулин детемир, инсулин гларгин] |
||
|
|
Халтофай |
Инсулин гларгин, без ограничения дозы |
Халтофай |
Инсулин деглюдек, максимальная разрешенная доза – 50 единиц |
|
Н |
278 |
279 |
199 |
199 |
|
HbA 1c ,% |
|
|
|
|
|
Начало → конец исследования |
8,4→6,6 |
8,2→7,1 |
8,7→6,9 |
8,8→8,0 |
|
Средняя смена |
˗1,81 |
₋1,13 |
₋1,90 |
₋0,89 |
|
Рассчитана разница |
|
₋0,59 АБ [₋0,74; ₋0,45] |
|
₋1,05 АБ [₋1,25; ₋0,84] |
|
Пациенты (%), достигшие HbA 1c < 7% |
|
|
|
|
|
Все пациенты |
71,6 |
47,0 |
60,3 |
23,1 |
|
Рассчитанный показатель отношения шансов |
|
3,45 Б [2,36; 5,05] |
|
5,44 Б [3,42; 8,66] |
|
Пациенты (%), достигшие HbA 1c £ 6,5% |
|
|
|
|
|
Все пациенты |
55,4 |
30,8 |
45,2 |
13,1 |
|
Рассчитанный показатель отношения шансов |
|
3,29 Б [2,27; 4,75] |
<span style=" |
|
Отзывы пользователей
У этого продукта еще нет отзывов.
Оставить отзыв
Смотрите другие товары в категории:
Обратите внимание
Информация/инструкция к препарату носит информационный характер и предназначена исключительно для ознакомительных целей.


